
L’échelle de pH et les indicateurs acidobasiques
Secondaire 3-4
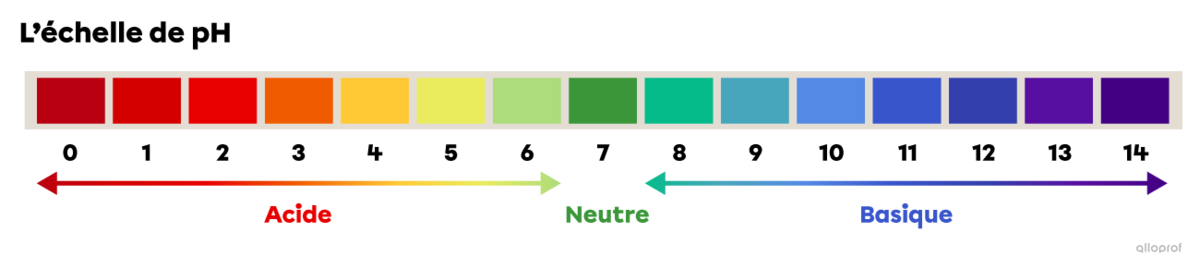
L’échelle de pH
Choisis ton niveau.
Secondaire 3
-
Le pH, abréviation de potentiel hydrogène, est une mesure qui permet de déterminer le degré d’acidité ou de basicité d’une solution. Le pH n’a pas d’unité de mesure.
-
L’échelle de pH permet de comparer le caractère acide, neutre ou basique des solutions. L’échelle de pH varie généralement de 0 à 14.
Secondaire 4
Une solution aqueuse comprend toujours des ions hydrogène |(\text{H}^+)| et des ions hydroxyde |(\text{OH}^-)|. La valeur du pH d’une solution aqueuse dépend de la concentration des ions |\text{H}^+| par rapport à la concentration des ions |\text{OH}^-| présents dans la solution.
-
Lorsque la concentration en ions |\text{H}^+| est plus grande que la concentration en ions |\text{OH}^-,| le pH est plus petit que 7 et la solution est acide.
-
Lorsque la concentration en ions |\text{H}^+| est égale à la concentration en ions |\text{OH}^-,| le pH est égal à 7 et la solution est neutre.
-
Lorsque la concentration en ions |\text{H}^+| est plus petite que la concentration en ions |\text{OH}^-,| le pH est plus grand que 7 et la solution est basique.
Pour évaluer le degré d’acidité ou de basicité d’une solution aqueuse, on peut se servir de l’échelle de pH.
-
Un acide est une substance qui permet la libération d’ions |\text{H}^+| en solution aqueuse.
-
Une base est une substance qui permet la libération d’ions |\text{OH}^-| en solution aqueuse.
-
Le pH, abréviation de potentiel hydrogène, est une mesure qui permet de déterminer le degré d’acidité ou de basicité d’une solution. Le pH n’a pas d’unité de mesure.
-
L’échelle de pH permet de comparer le caractère acide, neutre ou basique des substances. L’échelle de pH varie généralement de 0 à 14.
Sur l’échelle de pH, 0 est la valeur la plus acide, 7 est neutre et 14 est la valeur la plus basique. L’image suivante indique le pH approximatif de quelques substances communes.

Important!
La variation d’une unité sur l’échelle de pH entraine la variation de l’acidité ou de la basicité d’une solution d’un facteur 10.
-
La diminution d’une unité sur l’échelle de pH signifie que l’acidité est multipliée par 10.
-
L’augmentation d’une unité sur l’échelle de pH signifie que la basicité est multipliée par 10.

Le jus de tomates, dont le pH est 4, est 10 fois plus acide que le café, dont le pH est 5, puisque la variation est une diminution de 1 unité sur l’échelle de pH.
Le jus de tomates est 100 fois plus acide que le lait, dont le pH est 6, puisqu’il y a une diminution de 2 unités sur l’échelle de pH |(10\ \times 10=100).|

La comparaison du pH du jus de tomates, du café et du lait
Afin de comparer un détergent à lessive (pH de 10) et l’eau de Javel (pH de 13), réponds aux questions suivantes.
-
Laquelle des deux substances est la plus basique?
-
Quelle est la variation de la basicité entre les deux substances?
Voir la solution

L'échelle de pH
Exercice
La concentration molaire des ions H+ et le pH (STE)
Il est possible de déterminer la concentration molaire des ions |\text{H}^+| d’une solution aqueuse à l’aide du pH de cette solution. Pour ce faire, on utilise la formule suivante.
|[\text{H}^+]=10^\text{-pH}|
où
|[\text{H}^+]\ :| concentration en ions |\text{H}^+| en moles par litre |(\text{mol/L})|
|\text{pH}\ :| valeur du pH
Une solution aqueuse d’acide chlorhydrique |(\text{HCl})| a un pH de |2{,}5.| Voici l’équation de dissociation de l’acide chlorhydrique dans l’eau.
||\text{HCl}_\text{(aq)}\rightarrow\text{H}^+_\text{(aq)}+\text{Cl}^-_\text{(aq)}||
Quelle est la concentration en ions |\text{H}^+| de cette solution?
Voir la solution
Astuce
Lorsque la concentration en ions |\text{H}^+| d’une solution est exprimée en notation scientifique dont le premier facteur est 1, on peut déterminer le pH de cette solution en repérant l’exposant.
| |[\text{H}^+]| en |\text{mol/L}| | pH |
|---|---|
| |1\ \times\ 10^{-\color{#7CCA51}{1}}| | |\color{#7CCA51}1| |
| |1\ \times\ 10^{-\color{#7CCA51}{2}}| | |\color{#7CCA51}2| |
| |1\ \times\ 10^{-\color{#7CCA51}{3}}| | |\color{#7CCA51}3| |
| |1\ \times\ 10^{-\color{#7CCA51}{4}}| | |\color{#7CCA51}4| |
| |1\ \times\ 10^{-\color{#7CCA51}{5}}| | |\color{#7CCA51}5| |
| |1\ \times\ 10^{-\color{#7CCA51}{6}}| | |\color{#7CCA51}6| |
| |1\ \times\ 10^{-\color{#7CCA51}{7}}| | |\color{#7CCA51}7| |
| |1\ \times\ 10^{-\color{#7CCA51}{8}}| | |\color{#7CCA51}8| |
| |1\ \times\ 10^{-\color{#7CCA51}{9}}| | |\color{#7CCA51}9| |
| |1\ \times\ 10^{-\color{#7CCA51}{10}}| | |\color{#7CCA51}{10}| |
| |1\ \times\ 10^{-\color{#7CCA51}{11}}| | |\color{#7CCA51}{11}| |
| |1\ \times\ 10^{-\color{#7CCA51}{12}}| | |\color{#7CCA51}{12}| |
| |1\ \times\ 10^{-\color{#7CCA51}{13}}| | |\color{#7CCA51}{13}| |
| |1\ \times\ 10^{-\color{#7CCA51}{14}}| | |\color{#7CCA51}{14}| |
Cette astuce exprime le fait que le pH est une fonction logarithmique. Pour en savoir plus sur le calcul du pH, tu peux consulter la fiche suivante.
Les indicateurs acidobasiques
Un indicateur acidobasique est une substance qui a la propriété de changer de couleur en fonction du pH.

La couleur de quelques indicateurs acidobasiques en fonction du pH
La phénolphtaléine est un indicateur qui peut être utilisé pour déterminer si une solution est basique. Il suffit d’en déposer quelques gouttes dans la solution en question et on observe s’il y a un changement de couleur.
-
Si la phénolphtaléine reste incolore, on ne peut pas déterminer si la solution est acide (pH inférieur à 7), neutre (pH égal à 7) ou basique (dans ce cas, pH entre 7 et 8,2).
-
Si l’indicateur devient rose, cela signifie que le pH de la solution se situe entre 8,2 et 10 et que la solution est basique.
-
Si l’indicateur devient fushia, cela signifie que le pH est supérieur à 10 et que la solution est basique.
En bref, si la phénolphtaléine devient rose ou fushia lorsqu’elle est mélangée à une solution, cette solution est nécessairement basique.

La couleur de la phénolphtaléine en fonction du pH
Dans une éprouvette remplie de jus de citron de pH 2, on ajoute quelques gouttes d’un indicateur acidobasique : le bleu de thymol. On s'assure que le bleu de thymol soit bien mélangé avec le jus de citron et on observe le changement de couleur.
En te référant à l’image La couleur de quelques indicateurs acidobasiques en fonction du pH, détermine quelle sera la couleur du bleu de thymol après avoir été mélangé avec le jus de citron.

L’ajout de bleu de thymol dans du jus de citron
Voir la solution
On ajoute quelques gouttes de jaune de méthyle à une substance inconnue et la solution devient orange. Dans une deuxième éprouvette, on ajoute du vert de bromocrésol et la solution inconnue devient verte.
En te référant à l’image La couleur de quelques indicateurs acidobasiques en fonction du pH, détermine dans quel intervalle se situe la valeur du pH de cette substance inconnue.

La réaction du jaune de méthyle et du vert de bromocrésol avec une substance inconnue