
L'histoire du modèle atomique
Secondaire 4

L'histoire du modèle atomique

L'histoire du modèle atomique
Le modèle de Démocrite
Démocrite est un philosophe de l’Antiquité ayant vécu environ 400 ans avant notre ère. Il est à l’origine d'un des premiers modèles atomiques.
Démocrite affirme que la matière est constituée de particules très petites qu’il est impossible de briser ou de diviser. Il appelle ces particules atomes (atomos en grec, qui signifie indivisible). Il pense que ces particules sont séparées par du vide. C’est pourquoi sa représentation de la matière est appelée le modèle de la discontinuité.

Démocrite
Natata, Shutterstock.com

Le modèle atomique de Démocrite
Selon lui, la façon dont les atomes sont répartis dans la matière expliquerait pourquoi une substance aurait des propriétés différentes d’une autre substance. Par exemple, le fait que le plomb soit plus lourd que le liège s’expliquerait par le fait que les atomes y sont plus entassés.
Le modèle d’Aristote
Environ 100 ans plus tard, le philosophe Aristote s’oppose à l’idée de Démocrite. Selon lui, la matière doit remplir totalement l’espace qu’elle occupe. Il n’y a pas de vide. C’est pourquoi on appelle son idée le modèle de la continuité.

Aristote
Natata, Shutterstock.com

Le modèle atomique d'Aristote
Aristote affirme que la matière est divisible à l’infini, contrairement à ce que disait Démocrite, qui pense qu’il existe des particules indivisibles, les atomes.
Aristote pense aussi que la matière est constituée de quatre éléments : la terre, le feu, l’air et l’eau. Selon lui, ces éléments sont mélangés en proportions différentes pour former les diverses substances qui nous entourent.
À cette époque, les gens croient plus à la théorie d’Aristote qu’à celle de Démocrite, même si on sait aujourd’hui que le modèle de Démocrite est plus près de la réalité.
Le modèle de Dalton
John Dalton est un chimiste et physicien anglais qui a vécu entre 1766 et 1844. Contrairement à ses deux prédécesseurs, Démocrite et Aristote, Dalton construit son modèle à partir d’expérimentations scientifiques. Il se base sur des observations faites par différents scientifiques et par lui-même pour construire son modèle.

John Dalton
Naci Yavuz, Shutterstock.com
Ses observations
Dalton observe que certains gaz se dissolvent mieux dans l’eau que d’autres gaz. Après analyses, il suggère que les gaz (constitués d’atomes) ne sont pas tous identiques. Il pense que si certains gaz se dissolvent plus que d’autres, c’est parce que les atomes qui les constituent ont des masses différentes.
Dalton s’appuie également sur les travaux des chimistes Joseph Proust et Antoine Laurent de Lavoisier. Proust observe que chaque substance se divise toujours en mêmes produits et en mêmes proportions. Lavoisier démontre que lors d’une réaction chimique, la masse des réactifs avant l’expérience est toujours égale à la masse des produits après l’expérience, d’où sa célèbre phrase : « Rien ne se perd, rien ne se crée, tout se transforme. »
La description du modèle atomique de Dalton
À la suite de ses observations, Dalton propose un nouveau modèle atomique, qu’il appelle la théorie atomique. Il énonce 4 points importants.
- La matière est composée de petites particules invisibles et indivisibles appelées atomes.
- Les atomes d’un même élément sont identiques. Ils ont les mêmes propriétés et la même masse.
- Les atomes d’éléments différents ont des propriétés et des masses différentes.
- Les atomes peuvent se combiner pour former une nouvelle substance. La molécule produite possède des propriétés différentes des atomes qui la constituent.

Atomes et molécules selon Dalton
La représentation des atomes et molécules telle que dessinée par Dalton, tirée de son ouvrage Un nouveau système de philosophie chimique, publié en 1808.
Important!
Pour avoir plus d’informations sur ce modèle atomique et savoir comment dessiner les atomes et les molécules selon la représentation de Dalton, consulte la fiche sur le modèle atomique de Dalton.
Le modèle de Thomson
Joseph John Thomson est un physicien britannique qui a vécu entre 1856 et 1940. Il fait la découverte d’une petite particule, l’électron, qui l’amène à modifier le modèle de Dalton. C’est l’étude d’un rayon observé dans les tubes cathodiques qui a amené Thomson à faire sa découverte.

Joseph John Thomson
Natata, Shutterstock.com

L'électron
Le tube cathodique
À l’époque de Thomson, des scientifiques ont déjà commencé à faire des expériences sur l’électricité dans des tubes sous vide. Les tubes, appelés tubes cathodiques, comportent une électrode négative, la cathode, et une électrode positive, l’anode. En soumettant ces électrodes à un courant électrique, les scientifiques observent un faisceau lumineux, qui semble provenir de la cathode. On donne ainsi le nom de rayon cathodique au faisceau lumineux. À cette époque, les scientifiques ne connaissent pas la nature du rayon observé. Thomson se penche alors sur la question.

Tube cathodique
Ses conclusions
Thomson fait une série d’expériences et conclut que le rayon cathodique est formé de particules plus petites qu’un atome et qu’elles sont chargées négativement. Il appelle cette nouvelle particule l’électron.
À la lumière de ses expériences, Thomson suppose que l’atome n’est pas indivisible. En effet, il affirme que celui-ci est constitué en partie d’électrons. C’est alors qu’il propose un nouveau modèle atomique, en 1904.
La description du modèle atomique de Thomson

Le modèle atomique de Thomson
- L’atome n’est pas indivisible, puisqu’il est possible de lui arracher des électrons.
- L’atome est une boule de matière positive parsemée de petits grains négatifs, les électrons.
- Les charges négatives des électrons sont contrebalancées par la charge positive de la boule. De cette façon, l’atome est neutre.

Modèle du pain aux raisins de Thomson
Le modèle atomique de Thomson est appelé le modèle du pain aux raisins (plum pudding), puisqu’on peut comparer la mie du pain à la boule de matière positive et les raisins aux électrons qui sont répartis à l’intérieur du pain.

Le modèle atomique de Thomson
Le modèle de Rutherford
Ernest Rutherford est un physicien néo-zélandais qui a vécu entre 1871 et 1937. Lors d’une expérience, il fait une découverte pour le moins surprenante qui le mène à modifier le modèle atomique précédent : l’atome est en majorité vide. De plus, il découvre une nouvelle particule subatomique, le proton.

Ernest Rutherford

Le proton
Expériences et conclusions
Rutherford s’intéresse à la radioactivité, plus spécifiquement aux observations des scientifiques de son époque qui ont remarqué que les éléments radioactifs émettent différents types de radiations. Parmi ces types de radiations, il y a le rayonnement alpha, qui est formé de particules chargées positivement.
À partir de ces découvertes, Rutherford fait des expériences. Il bombarde une mince feuille d’or de ces particules chargées positivement et remarque que les particules passent en majorité à travers la feuille et que quelques-unes dévient de leur trajectoire.

L'expérience de la feuille d'or de Rutherford
Il conclut que l’atome est constitué majoritairement de vide, puisque la majorité des particules passe à travers la feuille (1). Il conclut également que l’atome a un noyau petit et dense en son centre, sur lequel les particules rebondissent (2) ou dévient de leur trajectoire (3). Ce noyau est formé de particules positives, qu’il appelle protons.
La description du modèle atomique de Rutherford

Modèle atomique de Rutherford
- L’atome est principalement constitué de vide.
- L’atome a un noyau petit et dense, formé de particules positives, les protons.
- Les électrons gravitent autour du noyau.
- Un atome neutre possède autant d’électrons que de protons.
Toutefois, ce modèle a quelques limites. Entre autres, il n’explique pas pourquoi les électrons, de charge négative, ne s’écrasent pas sur le noyau, de charge positive.
Le modèle de Rutherford-Bohr
Niels Bohr est un physicien danois et l’élève de Rutherford. Il apporte une précision au modèle de son professeur qui explique pourquoi les électrons, de charge négative, ne s’écrasent pas sur le noyau, de charge positive. Cette précision explique aussi les raies d’émission, qui sont des couleurs de lumière émises lorsqu’on donne de l’énergie à une substance.

Niels Bohr
Naci Yavuz, Shutterstock.com
Bohr suppose que les électrons circulent sur des orbites, qu’il appelle couches électroniques. Chaque couche électronique correspond à un niveau d’énergie précis. Plus l’électron se situe sur une couche éloignée du noyau, plus il a d’énergie.
Les électrons peuvent se déplacer d’une couche à une autre selon leur gain ou leur perte d’énergie. Si on fournit de l’énergie à un électron, il se déplace vers une couche supérieure.
Toutefois, l’électron ne reste pas sur la couche supérieure. Il redescend sur sa couche de départ. En descendant, il perd de l’énergie, qu’il émet sous forme de lumière.

Déplacement d'un électron vers une couche supérieure

Retour d'un électron vers sa couche de départ
Dépendamment des niveaux de départ et d’arrivée de l’électron, les couleurs de lumière émise sont différentes. En effet, chaque élément du tableau périodique a un spectre de raies de lumière qui lui est propre.
La description du modèle de Rutherford-Bohr
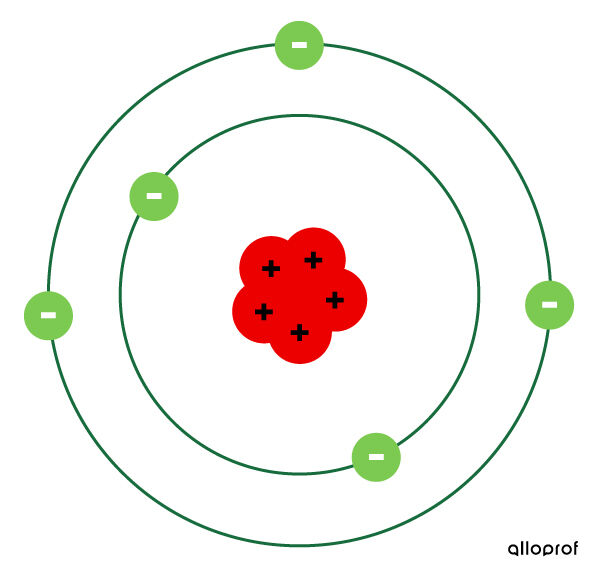
Modèle atomique de Rutherford-Bohr
- L’atome est représenté par un espace presque vide avec, au centre, un noyau dense contenant les protons.
- Les électrons circulent autour du noyau de l’atome sur les couches électroniques.
- Il peut y avoir plus d’un électron par couche électronique.
- Un atome neutre possède autant d’électrons que de protons.
Ce modèle n’est pourtant pas encore parfait. Il n’explique pas comment les protons, tous de charge positive, restent liés entre eux dans le noyau au lieu de se repousser.
Important!
Pour savoir comment représenter les atomes selon la représentation de Rutherford-Bohr, consulte la fiche sur le modèle atomique de Rutherford-Bohr.
Le modèle atomique simplifié
En 1932, le physicien britannique James Chadwick apporte une précision au modèle de Rutherford-Bohr en expliquant pourquoi les particules positives du noyau ne se repoussent pas. Il découvre une nouvelle particule située dans le noyau. On l’appelle le neutron, puisqu’elle ne possède aucune charge électrique.

James Chadwick
ROMANVS Roman Mojzis, Shutterstock.com

Le neutron
Les neutrons se lient aux protons dans le noyau. Par le fait même, ils diminuent l’effet de leur répulsion. Ils permettent ainsi au noyau d’être stable.
On appelle ce modèle le modèle atomique simplifié pour le différencier des modèles atomiques plus complexes qui ont été élaborés dans les années suivantes.

Modèle atomique simplifié
Important!
Pour savoir comment représenter les atomes selon le modèle atomique simplifié, consulte la fiche sur le modèle atomique simplifié.
Références
Dans cette page
- Haut de page
- Le modèle de Démocrite
- Le modèle d’Aristote
- Le modèle de Dalton
- Ses observations
- Le modèle de Thomson
- Le tube cathodique
- La description du modèle atomique de Thomson
- Le modèle de Rutherford
- Expériences et conclusions
- La description du modèle atomique de Rutherford
- Le modèle de Rutherford-Bohr
- La description du modèle de Rutherford-Bohr
- Le modèle atomique simplifié